mitotracker染色
很高兴有机会参与这个mitotracker染色问题集合的讨论。这是一个多元且重要的话题,我将采取系统的方法,逐一回答每个问题,并分享一些相关的案例和观点。
1.线粒体为什么一定要活体观察用固定液固定细胞不就可
2.细胞自噬现象
3.细胞自噬的自噬形式
4.细胞自噬研究策略
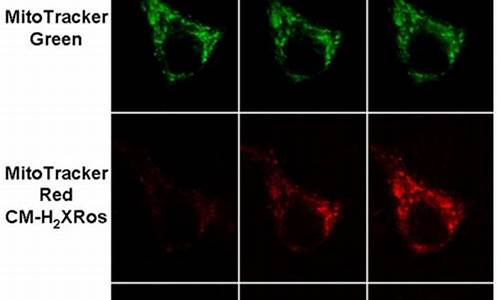
5.Mito Tracker Red CMXRos的标记原理是什么?
线粒体为什么一定要活体观察用固定液固定细胞不就可
1、 生活细胞的观察。
如将组织培养细胞或其他生活细胞,放在相差显微镜下,就可以看到细胞质内有线状小体活动,这就是线粒体。
2、 活细胞染色法。
就是利用某些无毒或毒性较小的染料,显示出细胞内某些特殊结构存在的真实性,而并不对细胞的活动有影响,如Janus green B(詹纳斯绿B),就是一种毒性较小的碱性染料。将其配制成一定浓度,对活细胞进行染色,在细胞质内可以看到被染成蓝绿色的线状或颗粒小体,这就是线粒体。还可看到其在细胞质内的活动状况。线粒体所以能显示出蓝绿色,是由于线粒体中具有细胞色素氧化酶系统,它是染料始终处于氧化状态呈蓝绿色,而在周围的细胞质中的染料被还原呈无色。
3、 固定染色法(即永久制片法)。
用特殊的固定液染色处理动物的组织或细胞后,可显示出线粒体的形态。但所用材料必须新鲜,否则线粒体常因已经破坏而显示不出,线粒体的组成成分主要是脂蛋白,脂类又以磷脂为主,用于线粒体的固定液含有饿酸,重铬酸钾等。因为两者均能使脂类物质保存下来,故可显示出线粒体的形态。用于显示线粒体形态的固定、染色方法较多,常用的有Altmann染色法、Regand染色法及Chmpy-Kull染色法等,但欲显示线粒体的细微结构,则要用电镜技术。
细胞自噬现象
健那绿,即Janus green B 染液,原来也曾译为詹纳斯绿 B,常用作线粒体专一性活体染色剂。 分子式C30H31ClN6 分子量511.07 原理线粒体中细胞色素氧化酶使染料保持氧化状态(即有色状态)呈蓝绿色,而在周围的细胞质中染料被还原,成为无色状态.
细胞自噬的自噬形式
细胞自噬(autophagy)的过程(以下有视频讲解)1)细胞接受自噬诱导信号后,在胞浆的某处形成一个小的类似"脂质体"样的膜结构,然后不断扩张,被称为Phagophore。
2)Phagophore不断延伸,将胞浆中的任何成分,全部揽入,然后"收口",成为密闭的球状的autophagosome,即"自噬体"。
3)自噬体形成后,可与细胞内吞的吞噬泡、吞饮泡和内体融合(这种情况不是必然要发生的)。
4)自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,2者的内容物合为一体,自噬体中的"货物"也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。
来自浙江大学团队的视频讲解
细胞自噬和多种疾病发生发展有关系
正常培养的细胞自噬活性很低,不适于观察,因此,必须对自噬进行人工干预和调节,经报道的工具药有:
一、自噬诱导剂
(1) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激
(2) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶)
(3) Earle's平衡盐溶液:制造饥饿
(4) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂
(5) Rapamycin:mTOR抑制剂
(6) Xestospongin B/C:IP3R阻滞剂
二、自噬抑制剂
(1) 3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂
(2) Bafilomycin A1:质子泵抑制剂
(3) Hydroxychloroquine(羟氯喹):Lysosomal lumen alkalizer(溶酶体腔碱化剂)
除了选用上述工具药外,一般还需结合遗传学技术对自噬相关基因进行干预:包括反义RNA干扰技术(Knockdown)、突变株筛选、外源基因导入等。
三、自噬过程进行观察和检测 细胞经诱导或抑制后,需对自噬过程进行观察和检测,常用的策略和技术有:
1、观察自噬体的形成
由于自噬体属于亚细胞结构,普通光镜下看不到,因此,直接观察自噬体需在透射电镜下。Phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。(autophagic vacuole,AV)
2、在荧光显微镜下采用GFP-LC3融合蛋白来示踪自噬形成
由于电镜耗时长,不利于监测(Monitoring)自噬形成,人们利用LC3在自噬形成过程中发生聚集的现象开发出了此技术。无自噬时,GFP-LC3融合蛋白弥散在胞浆中;自噬形成时,GFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,可以通过计数来评价自噬活性的高低。
3、利用Western Blot检测LC3-II/I比值的变化以评价自噬形成
自噬形成时,胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-II),因此,LC3-II/I比值的大小可估计自噬水平的高低。
(注意:LC3抗体对LC3-II有更高的亲和力,会造成假阳性。方法2和3需结合使用,同时需考虑溶酶体活性的影响。)
4、检测长寿蛋白的批量降解:非特异
5、MDC(Monodansylcadaverine,单丹磺酰尸胺)染色:包括自噬体,所有酸性液泡都被染色,故属于非特异性的。
6、CellTrackerTM Green染色:主要用于双染色,但其能染所有的液泡,故也属于非特异性的。
四、自噬相关蛋白的定位 在研究自噬相关蛋白时,需对其进行定位。
由于自噬体与溶酶体、线粒体、内质网、高尔基体关系密切,为了区别,常用到一些示踪蛋白在荧光显微镜下来共定位:
Lamp-2:溶酶体膜蛋白,可用于监测自噬体与溶酶体融合。
LysoTrackerTM 探针:有红或蓝色可选,显示所有酸性液泡。
pDsRed2-mito:载体,转染后表达一个融合蛋白(红色荧光蛋白+线粒体基质定位信号),可用来检测线粒体被自噬掉的程度(Mitophagy)。
MitoTraker探针:特异性显示活的线粒体,荧光在经过固定后还能保留。
Hsp60:定位与线粒体基质,细胞死亡时不会被释放。
Calreticulin(钙网织蛋白):内质网腔
(注意:这些蛋白均为胞浆蛋白,爬片或胰酶消化的细胞在做免疫荧光前需先透膜(permeablize),可采用0.1%SDS处理。)
参考
涨知识:细胞自噬的正确研究方法,实验基金都需要
细胞自噬研究策略
细胞自噬主要有三种形式:微自噬(microautophagy)、巨自噬(macroautophagy)和分子伴侣介导的自噬 (Chaperone-mediated autophagy,CMA)。 定义:指溶酶体或者液泡内膜直接内陷底物包裹并降解的过程。作用时间:多在种子成熟时储藏蛋白的沉积或萌发时储存蛋白的降解中起作用。 定义:在其过程中,底物蛋白被一种双层膜的结构(粗面内质网的无核糖体附着区脱落的双层膜)包裹后形成直径约400~900纳米大小的自噬小泡(autophagosome),接着自噬小泡的外膜与溶酶体膜或者液泡膜融合,释放包裹底物蛋白的泡状结构到溶酶体或者液泡中,并最终在一系列水解酶的作用下将其降解,我们将这种进入溶酶体或者液泡腔中的泡状结构称为自噬小体。
作用时间:营养缺乏条件下培养的细胞、植物的免疫反应、叶片衰老及环境胁迫应答。 (1) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激
(2) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶)
(3) Earle's平衡盐溶液:制造饥饿
(4) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂
(5) Rapamycin:mTOR抑制剂
(6) Xestospongin B/C:IP3R阻滞剂 (1) 3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂
(2) Bafilomycin A1:质子泵抑制剂
(3) Hydroxychloroquine(羟氯喹):Lysosomal lumen alkalizer(溶酶体腔碱化剂)
除了选用上述工具药外,一般还需结合遗传学技术对自噬相关基因进行干预:包括反义RNA干扰技术(Knockdown)、突变株筛选、外源基因导入等。 细胞经诱导或抑制后,需对自噬过程进行观察和检测,常用的策略和技术有:
1、观察自噬体的形成
由于自噬体属于亚细胞结构,普通光镜下看不到,因此,直接观察自噬体需在透射电镜下。Phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。(autophagic vacuole,AV)
2、在荧光显微镜下采用GFP-LC3融合蛋白来示踪自噬形成
由于电镜耗时长,不利于监测(Monitoring)自噬形成,人们利用LC3在自噬形成过程中发生聚集的现象开发出了此技术。无自噬时,GFP-LC3融合蛋白弥散在胞浆中;自噬形成时,GFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,可以通过计数来评价自噬活性的高低。
3、利用Western Blot检测LC3-II/I比值的变化以评价自噬形成
自噬形成时,胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-II),因此,LC3-II/I比值的大小可估计自噬水平的高低。
(注意:LC3抗体对LC3-II有更高的亲和力,会造成假阳性。方法2和3需结合使用,同时需考虑溶酶体活性的影响。)
4、检测长寿蛋白的批量降解:非特异
5、MDC(Monodansylcadaverine,单丹磺酰尸胺)染色:包括自噬体,所有酸性液泡都被染色,故属于非特异性的。
6、CellTrackerTM Green染色:主要用于双染色,但其能染所有的液泡,故也属于非特异性的。 在研究自噬相关蛋白时,需对其进行定位。由于自噬体与溶酶体、线粒体、内质网、高尔基体关系密切,为了区别,常用到一些示踪蛋白在荧光显微镜下来共定位:
Lamp-2:溶酶体膜蛋白,可用于监测自噬体与溶酶体融合。
LysoTrackerTM 探针:有红或蓝色可选,显示所有酸性液泡。
pDsRed2-mito:载体,转染后表达一个融合蛋白(红色荧光蛋白+线粒体基质定位信号),可用来检测线粒体被自噬掉的程度(Mitophagy)。
MitoTraker探针:特异性显示活的线粒体,荧光在经过固定后还能保留。
Hsp60:定位与线粒体基质,细胞死亡时不会被释放。
Calreticulin(钙网织蛋白):内质网腔
Mito Tracker Red CMXRos的标记原理是什么?
医学科研实验基础知识笔记(四):细胞自噬研究策略细胞自噬是指细胞在外界环境因素的影响下, 细胞利用溶酶体降解自身受损、 变性或衰老的大分子物质以及细胞器的自我消化过程。自噬是细胞的一种自我保护机制, 广泛存在于真核细胞内, 在调节细胞生存和死亡的过程中, 起着重要的作用。
当细胞发生自噬后, 在自噬相关基因的调节下, 细胞通过单层或双层膜, 包裹待降解的细胞质或细胞器, 形成囊泡状的自噬体(autophagosome) 。然后自噬体再和溶酶体(lysosome)
发生融合形成自噬溶酶体(autolysosome) , 由溶酶体内的一系列水解酶, 降解自噬溶酶体内所包裹的内容物, 以实现细胞对自身代谢和能量的更新。
1.自噬的细胞学分类及过程
根据细胞内物质运输到溶酶体的方式以及生理功能的差异, 哺乳动物的细胞自噬可以分为三种类型:大自噬/宏自噬(macroautophagy) , 小自噬/微自噬(microautophagy) 和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA) 。
1) 大自噬/宏自噬:我们通常所说的自噬指的就是大自噬/宏自噬。在大自噬的过程中, 细胞质中可溶性的大分子物质以及变性的细胞器, 被内质网、 线粒体来源的单层或双层膜包裹形成自噬体。接着自噬体的外膜与溶酶体膜融合, 进一步形成自噬溶酶体, 自噬体内的待降解物被一系列的水解酶降解, 最终完成整个的自噬过程。
2) 小自噬/微自噬:与大自噬过程不同, 是溶酶体膜自身发生内陷, 包裹和吞噬细胞内待降解的底物, 并在溶酶体内发生降解。小自噬与大自噬的区别就在于, 在小自噬过程中胞质成份是直接被溶酶体包裹, 没有形成自噬体的过程。
3) 分子伴侣介导的自噬:在分子伴侣介导发生的自噬过程中, 其待降解的底物都是可溶性的蛋白质分子。分子伴侣蛋白识别带有特定氨基酸序列的底物蛋白质分子, 并与之结合, 然后再经溶酶体膜上的受体 Lamp2a(lysosome-associated membrane protein 2, Lamp2) 转运到溶酶体;底物蛋白分子再在溶酶体内, 被水解酶降解。因此, 分子伴侣介导的自噬与前两者不同, 在降解蛋白时具有选择性。而大自噬和小自噬现象中, 一般而言, 在降解蛋白时没有明显的选择性。
2.自噬信号通路
3.自噬与凋亡的关系
细胞凋亡也被称为 I 型程序性细胞死亡;自噬则被称为 II 型程序性细胞死亡。凋亡和自噬是两种显著不同的细胞死亡形式, 两者在形态、 生化指标以及调控细胞死亡的过程上都存在着较大的差异, 但两者又不是两个完全独立的过程。许多研究表明, 凋亡和自噬的作用以及功能在某些情况下也是相互影响和制约的。自噬和凋亡之间存在着三种不同类型的相互作用,而且每种类型都对应着相应的特定的细胞类型、 刺激和环境。
1) 自噬和凋亡互相协同, 共同促进细胞死亡。两种效应之间, 可以其中一种效应影响另一种效应;自噬也可以作为凋亡的上游调节因子, 直接调控细胞凋亡, 从而影响细胞的死亡;
2) 自噬可以通过促进细胞存活而拮抗细胞的凋亡效应。比如, 可以通过去除因氧化应激受损的细胞器, 或降解变性的大分子物质, 为饥饿的细胞提供生存所需要的营养和能量;或者通过降解未折叠的蛋白来抑制内质网应激。自噬的这些功能将会抑制促凋亡信号的产生, 从而起到拮抗细胞凋亡的作用。
3) 自噬有时虽然自身并没有导致细胞死亡, 但却参与了细胞凋亡的过程。比如自噬参与了一些 ATP 依赖的凋亡过程。
4.自噬的分子机制和特征
1) 自噬诱导阶段(induction) :正常生理状态下, 细胞保持很低的基础自噬水平。这时细胞内能量充足,哺乳动物雷帕霉素靶蛋白复合物 1(也就是 mTOR 复合物 1,也叫做 mTORC1)处于活化的状态。活化的 mTORC1 通过磷酸化的方式使得 ATG13 发生磷酸化反应, 从而抑制细胞的自噬。
2) 成核过程(vesicle nucleation) :成核过程和 Vps34-ATG6 复合物密切相关。这个复合物还包含有调节性蛋白激酶 Vps15, 共同作用于膜泡的成核, 介导 PAS(也就是前自噬体结构pre-autophagosomal structure)的形成。
Vps34-ATG6 复合体还可以召集 ATG12-ATG5 和 ATG16 多聚体以及 LC3, 并通过后两者促进吞噬泡的伸展扩张。请大家注意, Vps34 在哺乳动物中的同源蛋白是 class III PI3K;ATG6在哺乳动物中的同源蛋白是 Beclin-1, 所以 Vps34-ATG6 复合体, 也被称为 PI3K-Beclin-1复合物。
3) 自噬体的延伸阶段:这个过程的分子机制是最为复杂的。哺乳动物自噬体的延伸主要依赖于两个类泛素化的系统:a) ATG12 的结合过程;b) LC3 的修饰过程。
ATG12 的结合过程是类似泛素化的过程, 需泛素活化酶 E1 和 E2 的参与。ATG12 首先由 E1样酶 ATG7 活化, 再通过 E2 样酶 ATG10 转运并结合 ATG5, 然后和 ATG16 结合, 生成ATG12-ATG5-ATG16 的多体复合物。这个复合物定位于前自噬体结构的外膜表面, 并参与前自噬体外膜的扩张。
LC3 在酵母中的同源基因是 ATG8。LC3 的修饰过程同样需要类似泛素活化酶 E1 和 E2 的参与。LC3 前体形成后被 ATG4 加工成胞浆可溶性的 LC3-Ⅰ, 然后在 E1 样酶 ATG7 和 E2样酶 ATG3 的作用下, 和磷脂酰乙醇胺(PE)共价连接成为脂溶性的 LC3-PE(也就是 LC3-II),并参与膜的延伸。LC3-Ⅱ能够与新形成的膜结合, 直到自噬溶酶体(Autolysosome)的形成。因此, LC3-Ⅱ常用作自噬形成的标识物, 也是一种重要的定位于自噬泡膜上的多信号传导调节蛋白。
哺乳动物的 ATG12-ATG5 类泛素化过程和 LC3 类泛素化过程并不是独立运行的, 它们之间可以相互作用、 相互调节。
4) 自噬体的成熟阶段:自噬体的成熟主要是指自噬体通过微管骨架在转运必须内吞体分类复合物(ESCRT)和单体 GTP 酶(Rab S)作用下, 与溶酶体融合形成自噬溶酶体的过程。参与成熟阶段的溶酶体相关蛋白还包括:LAMP1、 LAMP2、 UVRAG(紫外线抵抗相关肿瘤抑制基因)。
5) 自噬体的裂解阶段:是指自噬溶酶体膜的裂解及内容物在溶酶体水解酶的作用下降解的过程。降解过程中产生的氨基酸及部分蛋白可以为细胞提供营养、 能量或循环利用。
5.自噬诱导剂
a) Bredeldin A / Thapsigargin / Tunicamycin :模拟内质网应激
b) Carbamazepine/ L-690,330/ Lithium Chloride(氯化锂):IMPase 抑制剂(即Inositol monophosphatase,肌醇单磷酸酶)
c) Earle's平衡盐溶液:制造饥饿
d) N-Acetyl-D-sphingosine(C2-ceramide):Class I PI3K Pathway抑制剂
e) Rapamycin:mTOR抑制剂
f) Xestospongin B/C:IP3R阻滞剂
6.自噬抑制剂
a) 3-Methyladenine(3-MA):(Class III PI3K) hVps34 抑制剂
b) Bafilomycin A1:质子泵抑制剂
c) Hydroxychloroquine(羟氯喹)
除了选用上述工具药外,一般还需结合遗传学技术对自噬相关基因进行干预:包括反义RNA干扰技术(Knockdown)、突变株筛选、外源基因导入等。
7.自噬的检测手段
自噬的评估通常采用多个自噬阶段的标志物,因为自噬小体数量的增加可能是自噬上调也可能是自噬最后阶段降解被抑制所致,所以设置合适的对照很有必要。
(1)透射电镜,电镜观察自噬体和溶酶体的超微结构;
(2)WB检测标志物LC3/Atg8和p62/SQSTM1;生化检测自噬体膜标志蛋白, 特别是ATG12、 ATG5 和 LC3;荧光显微镜检测 LC3 或GFP-LC3 斑点的形成;生化检测自噬底物 p62。
(3)WB检测Lamps、Atg5、Atg14和Beclin-1。
(4)组织蛋白酶Cathepsin活力检测。
(5)IF检测自噬潮autophagic flux
自噬过程进行观察和检测 细胞经诱导或抑制后,需对自噬过程进行观察和检测,常用的策略和技术有:
(1)观察自噬体的形成
由于自噬体属于亚细胞结构,普通光镜下看不到,因此,直接观察自噬体需在透射电镜下。Phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。(autophagic vacuole,AV)
(2)在荧光显微镜下采用GFP-LC3融合蛋白来示踪自噬形成
由于电镜耗时长,不利于监测(Monitoring)自噬形成,人们利用LC3在自噬形成过程中发生聚集的现象开发出了此技术。无自噬时,GFP-LC3融合蛋白弥散在胞浆中;自噬形成时,GFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,可以通过计数来评价自噬活性的高低。
(3)利用Western Blot检测LC3-II/I比值的变化以评价自噬形成自噬形成时,胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-II),因此,LC3-II/I比值的大小可估计自噬水平的高低。
(注意:LC3抗体对LC3-II有更高的亲和力,会造成假阳性。需要多种检测方法结合使用,同时需考虑溶酶体活性的影响。)
(4)检测长寿蛋白的批量降解:非特异
(5)MDC(Monodansylcadaverine,单丹磺酰尸胺)染色:包括自噬体,所有酸性液泡都被染色,故属于非特异性的。
(6)CellTrackerTM Green染色:主要用于双染色,但其能染所有的液泡,故也属于非特异性的。
自噬相关蛋白的定位 在研究自噬相关蛋白时,需对其进行定位。
由于自噬体与溶酶体、线粒体、内质网、高尔基体关系密切,为了区别,常用到一些示踪蛋白在荧光显微镜下来共定位:
Lamp-2:溶酶体膜蛋白,可用于监测自噬体与溶酶体融合。
LysoTrackerTM 探针:有红或蓝色可选,显示所有酸性液泡。
pDsRed2-mito:载体,转染后表达一个融合蛋白(红色荧光蛋白+线粒体基质定位信号),可用来检测线粒体被自噬掉的程度(Mitophagy)。
MitoTraker探针:特异性显示活的线粒体,荧光在经过固定后还能保留。
Hsp60:定位与线粒体基质,细胞死亡时不会被释放。
Calreticulin(钙网织蛋白):内质网腔
(注意:这些蛋白均为胞浆蛋白,爬片或胰酶消化的细胞在做免疫荧光前需先透膜(permeablize),可采用0.1%SDS处理。)
8.自噬研究常规思路
通常情况下,除了研究自噬现象本身,大家更多的是将自噬与各种生命活动或者疾病结合起来,把自噬作为这些方向的一个机制来研究。比如研究自噬如何参与肿瘤的发生发展、如何参与肿瘤的耐药性与复发转移、如何参与肿瘤免疫治疗的效果、如何参与炎症反应、如何参与氧化应激,如何参与自闭症、阿尔兹海默症的发生与治疗等,通常的研究模式:
(1)证明自噬参与了相关研究表型(电镜、LC3II/I-WB、LC3亚细胞定位、LC3荧光示踪监测自噬流等)
(2)证明自噬在表型中起到关键作用(通过自噬抑制剂、激动剂进行关联研究)找到表型与自噬桥梁分子(检测pI3K通路、Beclin-1、ATG家族各成员)
(3)在基因层面通过gain of/lost of function研究桥梁分子在自噬中的作用。
9.研究自噬的文献参考
[1]. Emerging Mechanisms in Initiating and Terminating Autophagy. Trends Biochem Sci. 2017 Jan;42(1):28-41.
[2]. Targeting autophagy in cancer. Nat Rev Cancer. 2017 Sep;17(9):528-542.
[3]. Autophagy: controlling cell fate in rheumatic diseases. Nat Rev Rheumatol. 2016 Sep;12(9):517-31.
[4]. Crosstalk between autophagy and inflammatory signalling pathways: balancing defence and homeostasis. Nat Rev Immunol. 2016 Nov;16(11):661-675.
[5]. Autophagy and Neurodegeneration: Pathogenic Mechanisms and Therapeutic Opportunities. Neuron. 2017 Mar 8;93(5):1015-1034.
[6]. Activating autophagy to potentiate immunogenic chemotherapy and radiation therapy. Nat Rev Clin Oncol. 2017 Apr;14(4):247-258.
[7]. Epigenetic Control of Autophagy: Nuclear Events Gain More Attention. Mol Cell.2017 Mar 2;65(5):781-785.
[8]. Pharmacological modulation of autophagy: therapeutic potential and persisting obstacles. Nat Rev Drug Discov.2017 Jul;16(7):487-511.
原理:用于对活细胞线粒体进行染色,该染料的积累取决于膜电位。定义:MitoTracker Red CMXRos 是一种红色荧光染料,用于对活细胞线粒体进行染色,并且该染料的积累取决于膜电位。乙醛固定后,该染料可稳定保存。
荧光染料常用于荧光染料产品的制备,以及增白洗衣粉中的增白剂,指示信号用的各种荧光路标漆,荧光标志服等。
荧光染料的其他用途包括: 渗漏污水系统包括水和工业的污染物、连接系统、测量发电厂排出的液体、洗手间的渗漏、非法的连接污水管监察,研究流量和绘图,分析腐败的系统,此外还用于纤维织物印染和某些特种标志(如暗处符号)及军事追踪等。
扩展资料:
荧光标记的单克隆抗体技术为流式细胞仪在研究细胞膜和细胞内各种功能性抗原、肿瘤基因蛋白等领域扩展了无限的应用空间。
荧光探针可以通过蛋白质交联剂共价结合在单克隆抗体上。免疫荧光标记最常用的染料有异硫氰酸荧光素(fluorescein isothiocyanate, FITC)、藻红蛋白(PE)以及AlexaFluor系列染料等。
核酸荧光染料对细胞核染色后定量测量细胞所发出的荧光强度,就可以确定细胞核中DNA、RNA的含量,并可以对细胞周期和细胞的增殖状况进行分析。
有多种荧光染料可以对细胞中的DNA或RNA染色,常用的DNA染料包括碘化丙啶(PI)、DAPI、Hoechst 33342等,RNA染料有噻唑橙、吖啶橙等。
百度百科-荧光染料
好了,今天关于“mitotracker染色”的探讨就到这里了。希望大家能够对“mitotracker染色”有更深入的认识,并且从我的回答中得到一些帮助。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












